
Металлические изделия автомобилей с течением времени постепенно покрываются ржавчиной. Этот процесс называется коррозией. Для того, чтобы замедлить этот процесс, металлическим изделиям нужна защита от коррозии. Вот о том, из чего состоит защита от коррозии, мы и поговорим в этой статье.
Процессы коррозии
 Коррозия — это разрушение металлов в результате их химического или электрохимического взаимодействия с окружающей средой. В процессе протекания этих реакций на поверхности металла адсорбируют окислительные компоненты. Это молекулы кислорода, углерода, азота и др. С позиций термодинамики процесс развития коррозии можно рассматривать как энтропию с передачей энергии от состояния высшего уровня к низшему, обладающему большей устойчивостью.
Коррозия — это разрушение металлов в результате их химического или электрохимического взаимодействия с окружающей средой. В процессе протекания этих реакций на поверхности металла адсорбируют окислительные компоненты. Это молекулы кислорода, углерода, азота и др. С позиций термодинамики процесс развития коррозии можно рассматривать как энтропию с передачей энергии от состояния высшего уровня к низшему, обладающему большей устойчивостью.
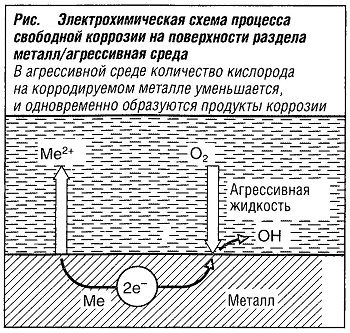
Процессы коррозии всегда проходят в виде межфазных реакций. Примером таких реакций является образование металлической окалины, то есть окисление в атмосфере нагретых газов. Таким же образом происходит коррозия на границе металла с водной фазой. Обычно она характеризуется как электрохимическая коррозия (рис. «Электрохимическая схема процесса свободной коррозии на поверхности раздела металл/агрессивная среда» ).
Коррозионное разрушение
При коррозионном разрушении развиваются две характерные реакции — анодирование и окисление металла, описываемые следующим уравнением:
Me -> Меn+ + nе—
с высвобождением эквивалентного количества электронов. Ионы металла, образуемые таким образом, могут растворяться в электролите. Также они осаждаются на металлической поверхности, подвергающейся коррозионному разрушению.
Анодный процесс продолжается до тех пор, пока высвобождающиеся электроны поглощаются во время реакции окисления. В катодном процессе происходит уменьшение кислорода и образование гидроксильных ионов в нейтральной или алкалиновой среде в соответствии с уравнением:
O2 + 2 Н2O + 4 е— -> 4 ОН—
Гидроксильные ионы, в свою очередь, могут вступать в реакцию с ионами металла в кислой среде. Здесь происходит образование свободного водорода, выделяемого в виде газа в соответствии с уравнением:
2 Н+ + 2 е— -> Н2.
Каждый из этих процессов соответствует своей зависимости ток-напряжение. Общая же сила тока складывается из показателей силы тока анодного Iа и катодного Ik процессов. (рис. «Частые и общие зависимости силы тока от напряжения для процессов свободной коррозии (в верхней полуплоскости) и контактной коррозии (в нижней полуплоскости)» )
Itotal = Iа + Ik
Для получения обобщающей зависимости силы тока от напряжения аналогичные частные зависимости обоих процессов объединяются.
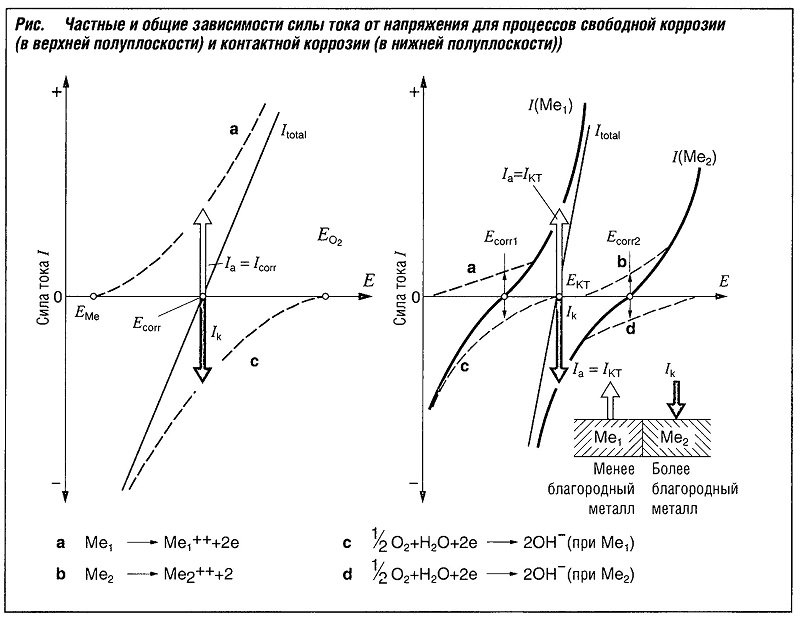
Если в зону контакта не подводится внешнее напряжение, то есть протекает процесс свободной коррозии, система находится в равновесном состоянии, когда сила тока анодного и катодного процессов сбалансированы:
Iа = -Ik = Icorr
В этом случае анодный ток называют током коррозии Icorr, а соответствующую величину напряжения — потенциалом открытой цепи — Еcorr
Потенциал открытой цепи представляет собой смешанный неравновесный потенциал, постоянно преобразуемый в соответствии с уравнением:
O2 + 2 Н2O + (4/n) Ме -> (4/n) Меn++ 4OН—
Эта закономерность применима для процесса контактной коррозии (см. рис. выше). Хотя взаимосвязь определяющих ее параметров более сложная. В дополнение к частным и общим зависимостям ток-напряжение, для характеристики процесса коррозии необходимо также получить аналогичную результирующую зависимость для всей системы.
Электрохимические ряды металлов
Металлы часто располагают по электромеханическим рядам в соответствии с их стандартным потенциалом (рис. «Стандартные электрические потенциалы металлов» ).  Термин «стандартный потенциал» означает, что параметры металла определены в стандартных условиях, в частности, электрохимическая активность ионов металла и водорода определяется в растворе концентрацией 1 моль/л при давлении водорода 0,1 МПа и температуре 25 °С. Такие условия в природе встречаются редко, в действительности большинство растворов не содержат ионы металла в свободном состоянии.
Термин «стандартный потенциал» означает, что параметры металла определены в стандартных условиях, в частности, электрохимическая активность ионов металла и водорода определяется в растворе концентрацией 1 моль/л при давлении водорода 0,1 МПа и температуре 25 °С. Такие условия в природе встречаются редко, в действительности большинство растворов не содержат ионы металла в свободном состоянии.
Следует иметь в виду, что изложенные выше соображения ограничены термодинамической оценкой коррозии и не отражают кинетики процесса, связанного с образованием защитного слоя. При оценке коррозии может использоваться зависимость между электрическим потенциалом металлов и подверженностью их коррозии без приложения внешнего напряжения.
Эта зависимость показывает, как в результате вторичной реакции происходит образование защитного слоя на различных металлах.
Наиболее окисляющиеся, неблагородные металлы, потенциал которых менее —0,4 В, например, Na, Mg, Be, Al, Ti и Fe корродируют в нейтральном водном растворе даже при отсутствии кислорода.
Окисляющиеся металлы, потенциал которых между -0,5 и 0 В, например, Cd, Со, Ni, Sn и Pb корродируют в нейтральном водном растворе в присутствии кислорода и в кислом растворе с образованием водорода даже при отсутствии кислорода.
Полублагородные металлы, потенциал которых от 0 до +0,7 В, например, Cu, Hg и Ag корродируют во всех растворах только при наличии кислорода.
Благородные металлы, потенциал которых выше +0,7 В, например, Pd, Pt и Au устойчивы к коррозии. Эти категории металлов могут подвергаться коррозии при приложении к ним внешнего напряжения.
Виды коррозии
Сплошная поверхностная коррозия
Однородное разрушение металла по всей поверхности контакта подверженных коррозионному воздействию деталей. Это наиболее часто встречающийся вид коррозии, при котором интенсивность корродирования (глубина пораженного коррозией слоя) может быть оценена в единицу времени по величине тока коррозии.
Питтинговая коррозия
Ограниченное местное коррозионное воздействие, проникающее вглубь металла, в результате чего образуются язвы и раковины, глубина которых может значительно превышать их диаметр. При этом практически не происходит поверхностного разрушения металла за пределами точечных поражений и раковин. Точечная коррозия часто вызывается ионами галогенов.
Контактная коррозия
Когда два различных металла, увлажненные агрессивной средой, находятся во взаимном электрическом контакте, катодный подпроцесс происходит в более благородном металле, в то время как анодный подпроцесс прогрессирует в менее благородном материале. Это называют контактной коррозией.
Коррозия трещинами
Коррозионное воздействие, например, вследствие длительного окисления металла, преимущественно проявляющееся в узких трещинах и щелях, вызываемых концентрацией в металле внутренних напряжений. Интенсивность этого вида коррозии возрастает в плохо вентилируемых помещениях.
Коррозия усталостными трещинами
Коррозия, развивающаяся в результате механических нагрузок, возникающих, в том числе, под действием внутренних напряжений растяжения и непосредственного коррозионного воздействия. Часто при этом в металле возникают корродируемые межкристаллические и транскристаллические трещины, не поддающиеся визуальному обнаружению.
Коррозия вибрационными трещинами
Коррозия, вызываемая одновременно коррозионным воздействием и высокими усталостными напряжениями вследствие вибрации металлических конструкций, с формированием и развитием усталостных трещин, часто невидимых невооруженным взглядом.
Межкристаллическая и транскристаллическая коррозия
Этот вид коррозии характеризуется раздельным ее формированием в направлениях вдоль межкристаллических связей и в плоскости, параллельной упругой деформации кристаллических зерен.
Разрушение цинка
Выборочное разрушение цинка, входящего в состав латуни, в результате чего остается пористая структура медной составляющей сплава. Аналогичным образом вследствие коррозии происходит выделение никеля и алюминия из легированных сплавов.
Испытания на коррозионную стойкость
Электрохимический метод испытания
Применяется для определения величины тока коррозии, достаточной для образования определенной глубины слоя и массы металла, периодически теряемого вследствие коррозии. Также определяется зависимость между напряжением коррозии и свойствами испытываемого металла. Параметры коррозии приведены в табл. «Нормируемые методы испытаний на коррозионную стойкость».
Электрохимический метод испытаний количественными показателями дополняет другие методы оценки коррозионной стойкости металлов.
Измерение сопротивления поляризации
Свободная коррозия определяется на основе величины, соответствующей углу наклона кривой зависимости тока от потенциала открытой цепи. Воздействие на металл при испытаниях минимальное, при этом изменяются только импульсы анодного и катодного токов.
Импедансная спектроскопия
Для, изучения механизма коррозии применяется метод электрохимической импедансной спектроскопии (метод EIS).  Этот метод позволяет определить полное сопротивление (импеданс) в цепи переменного тока и угол сдвига фаз испытываемого элемента в функции частоты тока. Низкоамплитудное синусоидальное напряжение переменного тока накладывается на потенциал электрода и производится замер тока реакции. По результатам измерений система, (например, система «агрессивная среда-покрытие-металл», рис. «Оценка системы агрессивная среда-покрытие-металл» ) аппроксимируется в схему замещения.
Этот метод позволяет определить полное сопротивление (импеданс) в цепи переменного тока и угол сдвига фаз испытываемого элемента в функции частоты тока. Низкоамплитудное синусоидальное напряжение переменного тока накладывается на потенциал электрода и производится замер тока реакции. По результатам измерений система, (например, система «агрессивная среда-покрытие-металл», рис. «Оценка системы агрессивная среда-покрытие-металл» ) аппроксимируется в схему замещения.
Для обеспечения соответствия схем замещения экспериментальным данным применяется метод подгонки параметров. Элементы импеданса (сопротивление, емкость, индуктивность) задаются физическими свойствами покрытия. На этой основе могут быть сделаны прямые выводы, касающиеся различных характеристик покрытия. Так, например, эффективности защиты от коррозии, пористости, толщины, способности абсорбировать воду, эффективности действия ингибиторов коррозии, степени коррозионного разрушения базового металла и т.д.
SRET
Для выявления коррозии на ранних стадиях ее развития и контроля за локальными коррозионными процессами применяется метод сканирования с использованием эталонного электрода (метод SRET).
 Примерами местных коррозионных процессов, которые могут в значительной мере изменять механические свойства материала и даже, в исключительных случаях, приводить к его разрушению, являются трещины, питтинг и межкристаллическая коррозия. Для таких процессов характерны высокая степень локального коррозионного разрушения и изменение локального электрического потенциала.
Примерами местных коррозионных процессов, которые могут в значительной мере изменять механические свойства материала и даже, в исключительных случаях, приводить к его разрушению, являются трещины, питтинг и межкристаллическая коррозия. Для таких процессов характерны высокая степень локального коррозионного разрушения и изменение локального электрического потенциала.
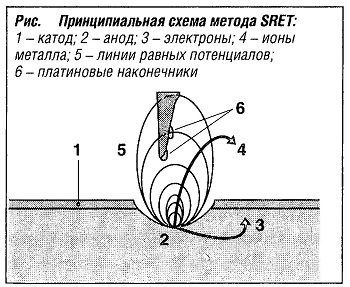
На принципиальной схеме метода SRET (рис. «Принципиальная схема метода SRET» ) показаны линии равных потенциалов в локальном очаге активной коррозии. Для сканирования сигналов из зоны коррозии используется датчик, который состоит из двух зафиксированных на поворачивающемся щупе и смещенных друг относительно друга платиновых наконечников, чувствительных к микроизменениям электрического потенциала.
Данные автоматически вводятся в компьютер, анализируются и отображаются в виде графиков. Метод SRET применяется для определения точечной коррозии, активации и репассивации, выявления дефектов в сварных соединениях и покрытиях из органических материалов, установления следов расслоения в слоистых материалах и т. п.
Электрохимический шум
Электрохимический шум, который может быть шумом напряжения или тока, следует из микроэлектрохимических действий на поверхности корродируемого металла. Критерием оценки служат небольшие стохастические колебания, производимые соответствующими источниками шума. Это позволяет идентифицировать изменения в системе на очень ранней стадии. Особое преимущество шумовой диагностики состоит в том, что в системе корродирования отсутствуют какие-либо внешние вмешательства.
Области применения — основные экспертизы местных процессов коррозии, локализация процессов коррозии и контроль коррозии.
Измерение тока контактной коррозии
Для оценки контактной коррозии определяют величину тока, протекающего между двумя погруженными в раствор металлами. Уменьшение силы тока вовремя электрохимической реакции достаточно полно отражает процесс коррозии на этапе эксплуатационных испытаний.
Преимуществами электрохимического метода измерения контактной коррозии по сравнению с другими методами являются относительно непродолжительное время испытания (один день), небольшой объем необходимого корродирующего раствора (несколько десятых долей литра), получение количественной оценки интенсивности процесса коррозии.
Неэлектрические методы испытаний металлов на коррозионную стойкость
Другие методы испытаний металлов на коррозионную стойкость основаны на определении уменьшения массы образца или уровня образования продуктов коррозии (ржавчины). 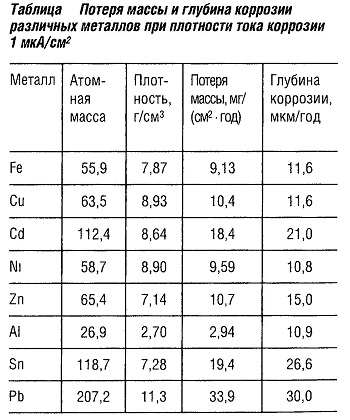 Стандарт DIM ЕМ ISO 4628-3 (бывший DIM 53210) классифицирует пять различных уровней образования коррозии (табл. «Потеря массы и глубина коррозии различных металлов при плотности тока коррозии 1 мкА/см2« ).
Стандарт DIM ЕМ ISO 4628-3 (бывший DIM 53210) классифицирует пять различных уровней образования коррозии (табл. «Потеря массы и глубина коррозии различных металлов при плотности тока коррозии 1 мкА/см2« ).
Испытания коррозионной стойкости должны отвечать эксплуатационным требованиям. В дополнение к требованиям стандарта DIM, методы испытаний должны включать и определение некоторых специальных показателей, например, при испытаниях на автомобиле (в разных климатических условиях, при забрызгивании водой топливной системы). Эти ускоренные испытания, имитирующие долговременный режим нагружения в реальных условиях, должны обеспечить получение данных о вероятном сроке службы при обычных эксплуатационных условиях, (такие испытания включают, например, выдерживание тестируемого изделия под воздействием различных климатических условий или проверку работы системы приготовления топливовоздушной смеси под струями воды).
Защита от коррозии
 Разнообразие проявлений и механизмов развития коррозии определяет широкий спектр мер по защите металлов от коррозионного разрушения, направленных на уменьшение интенсивности коррозии и увеличение долговечности изделия (см. табл. «Уровни образования коррозии и доля поверхности, подверженной коррозионному разрушению (DIN EN ISO 4628-3)».
Разнообразие проявлений и механизмов развития коррозии определяет широкий спектр мер по защите металлов от коррозионного разрушения, направленных на уменьшение интенсивности коррозии и увеличение долговечности изделия (см. табл. «Уровни образования коррозии и доля поверхности, подверженной коррозионному разрушению (DIN EN ISO 4628-3)».
Меры по защите от коррозии можно подразделить на четыре основные категории:
- Закладываемые на стадии разработки изделия (выбор соответствующих материалов и конструктивных решений);
- Влияющие на процесс коррозии электрохимическим способом;
- Обеспечивающие разделение металла и коррозионной среды путем применения защитных покрытий;
- Влияющие на саму коррозионую среду, например, путем введения в нее ингибиторов коррозии.
Защита от коррозии на стадии конструирования изделия
Одним из наиболее эффективных способов защиты от коррозии на стадии конструирования является выбор материалов, обладающих повышенной коррозионной устойчивостью. При учете расходов на ремонт, связанных с коррозионным разрушением во время предполагаемой эксплуатации изделия, экономически целесообразней использовать более дорогие материалы в случае, если они более устойчивы к воздействию коррозии.
Также при конструировании бывает важен подбор находящихся в контакте деталей, производимый таким образом, чтобы детали, с точки зрения их коррозионного взаимодействия, состояли из одинаковых или разных материалов.
При конструировании следует учитывать, что во время эксплуатации изделия бывает затруднена коррозионная защита углов и кромок. Снизить коррозию в этих конструктивных элементах может помочь правильная их ориентация относительно действия сил тяжести (рис. «Правильная и не правильная ориентация деталей с точки зрения исключения коррозии» ).
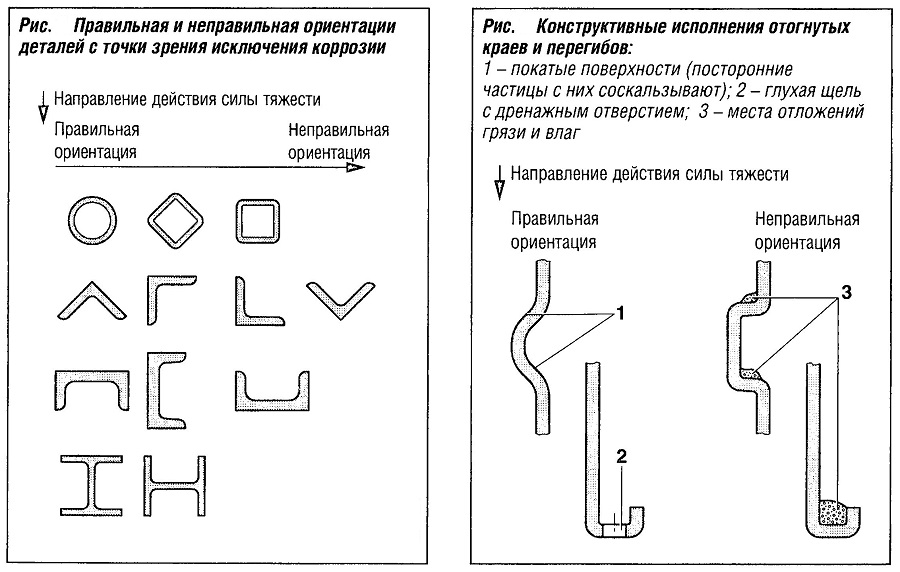
Перегибы и отогнутые края могут собирать грязь и влагу и для борьбы с этим следует располагать поверхности и дренажные отверстия таким образом, чтобы помочь в устранении этой проблемы (рис. «Конструктивные исполнения отогнутых краев и перегибов» ).
Сварочные швы, которые обычно ухудшают микроструктуру металла, с точки зрения воздействия на них коррозии являются слабым местом. Для того чтобы избежать так называемой щелевой коррозии, сварочные швы должны быть гладкими и сплошными (рис. «Способы устранения щелей в сварочных швах» ).
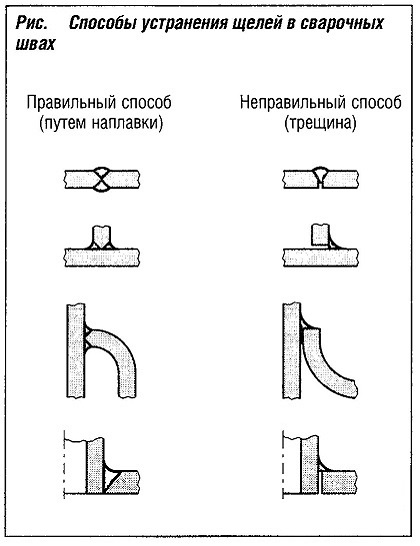 |
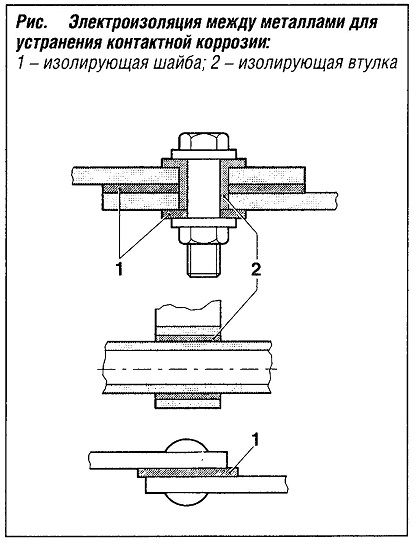 |
Контактная коррозия может быть устранена как за счет применения однородных материалов, так и путем установки шайб, прокладок или втулок, обеспечивающих электроизоляцию между металлами, коррозионноактивными при прямом контакте (рис. «Электроизоляция между металлами для устранения контактной коррозии» ).
Защита от коррозии электрохимическим способом
Зависимость тока от напряжения для металлов, поверхность которых подвергается пассивации, иллюстрирует электромеханический способ защиты от коррозии (рис. «Схематичная зависимость тока от напряжения в процессе пассивации металлической поверхности» ). 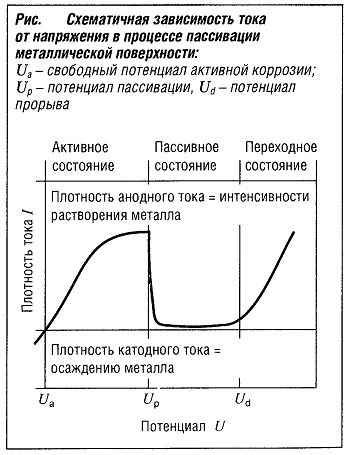 Кривая плотности тока, восходящая по оси ординат, представляет собой анодный ток реакции окисления, определяемой уравнением:
Кривая плотности тока, восходящая по оси ординат, представляет собой анодный ток реакции окисления, определяемой уравнением:
Me -> Меn+ + пе—
Кривая плотности тока, нисходящая по оси ординат, представляет собой катодный ток электрохимической реакции коррозии. Для подавления процесса развития коррозии к металлу может быть приложено внешнее напряжение. Реализация электрохимического способа защиты от коррозии проходит двумя путями.
При катодной защите потенциал реакции коррозии необходимо сместить в зону отсутствия анодного напряжения (U < Ua). В качестве альтернативного решения вместо приложения внешнего напряжения можно использовать основной металл, выполняющий роль анода.
При анодной защите потенциал реакции коррозии необходимо сместить в пассивную область напряжений (между Uр и Ud). Анодный ток в пассивной зоне превышает величину тока в активной зоне по экспоненциальной зависимости с показателем степени от 3 до 6. Значение показателя степени зависит от вида металла и типа корродирующей среды.
В результате достигается надежная защита металла, но при этом потенциал не должен превышать величины Ud, так как в этом случае будет образовываться свободный кислород, способствующий окислению металла.
Антикоррозионные покрытия
Антикоррозионные покрытия формируются в виде защитной пленки, наносимой непосредственно на металлическую поверхность, подверженную коррозионному воздействию агрессивной среды. Защитное покрытие не должно быть пористым и электропроводным и должно иметь достаточную толщину.
Ингибиторы коррозии
Ингибиторы — вещества, добавляемые в малых концентрациях в коррозионную среду. Максимум — это несколько сотен миллионных долей, для абсорбции на поверхности защищаемого металла. Они позволяют резко ослабить процесс коррозии путем блокирования анодного или катодного подпроцессов. Часто оба эти подпроцесса блокируются одновременно. Роль таких ингибиторов чаще всего выполняют амины и амиды органических кислот. В автомобилестроении ингибиторы используются в качестве присадок к топливу. Также их добавляются в охлаждающую жидкость для предотвращения коррозионного разрушения системы охлаждения двигателя.
Ингибиторы коррозии с испаряющейся фазой обеспечивают временную защиту металлических изделий при их хранении или транспортировке. Эти ингибиторы должны быть просты в применении и при этом легко удаляться. Недостатком является их потенциальная опасность для здоровья человека.
Испаряющиеся ингибиторы коррозии (VPI) и летучие ингибиторы коррозии (VCI) представляют собой органические соединения. Обычно их помещают в специальную упаковку или в виде растворимых жидких эмульсий в систему смазки. С течением времени такие ингибиторы коррозии испаряются и адсорбируют на металлических поверхностях в виде мономолекул. Таким образом, они замедляют протекание анодного и катодного подпроцессов коррозии (типовой пример — нитрит дициклогексиламина).
Для повышения эффективности ингибиторы коррозии применяют в виде уплотненного покрытия. Им заполняюют как можно большую площадь поверхности деталей и узлов. Ингибиторы коррозии этого типа применяются в виде уплотнений из специальной бумаги или полиэтиленовой фольги. Уплотнения могут вскрываться для осмотра и проверки содержания ингибитора коррозии. Продолжительность действия содержащегося в уплотнениях ингибитора коррозии зависит от степени затяжки уплотнительного узла и температуры (приблизительный срок службы обычно составляет два года; при температуре, превышающей комнатную, срок службы уменьшается).
Также они состоят из нескольких компонентов, обеспечивающих одновременную защиту разных металлов и их сплавов (исключение — кадмий, свинец, вольфрам, магний).
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ: