Термодинамика исследует явления, обусловленные совокупным действием огромного числа непрерывно движущихся частиц. Несмотря на то, что каждая из этих частиц движется по законам механики, их совокупное движение представляет собой качественно новый вид движения – тепловое движение. Если сказать проще, то термодинамика исследует превращение движения в теплоту и наоборот. Также термодинамика рассматривает физические и химические изменения, связанные с поглощением теплоты веществом и наоборот, выделение теплоты в ходе физических и химических превращений. Вот о том, что представляет собой термодинамика, мы и поговорим в этой статье.
Энтальпия (теплосодержание)
 |
 |
Энтальпия (теплосодержание) Q1 — это количество теплоты, в которое преобразуется твердое, жидкое или газообразное тело массой т и удельной теплоемкостью ср при определенной температуре Т.
Q1 = ср m Т = ср V ρ Т.
Пересчет не допускаемых к употреблению единиц измерения:
1 ккал (килокалория) = 4186,8 Дж ≈ 4,2 кДж;
1 ккал/(м*ч*град) = 1,163 Вт/(м*К).
Теплопередача
Существуют три формы теплопередачи:
- Теплопроводность — способность твердого, жидкого или газообразного тела переносить тепло;
- Конвекция — теплота, переносимая движущимися частицами жидкого или газообразного тела. При свободной конвекции характер движения частиц вызван неоднородностью среды; при вынужденной конвекции движение частиц поддерживается искусственно;
- Тепловое излучение — передача тепла от одного тела к другому благодаря испусканию и поглощению электромагнитных волн.
Теплопроводность
Тепловой поток, распространяющийся в теле с постоянной площадью поперечного сечения А между двумя параллельными плоскостями поперечного сечения, расположенными на расстоянии s, при разности температур ΔТ = T1 — Т2 равен:
Q.=λ/s ΔТ.
Тепловое излучение
Безвоздушное пространство и воздух проницаемы для теплового излучения. Твердые тела и большая часть жидкостей для теплового излучения непроницаемы, также, как и различные газы в определенных диапазонах длин волн.
Тепловое излучение, исходящее от поверхности площадью A при температуре T, равно:
Q. = ԑσA Т4,
Где:
σ= 5,67-10-8 Вт/(м2К4) — постоянная излучения абсолютно черного тела;
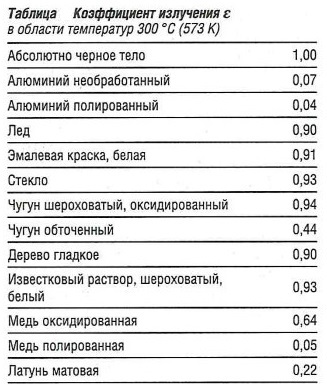
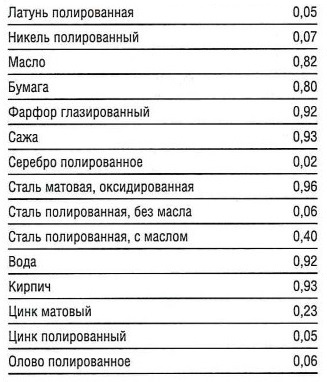
ԑ— коэффициент излучения поверхности (см. табл. «Коэффициент излучения ԑ» ).
 |
 |
Теплопередача через стену
 Тепловой поток, проходящий через стену площадью A и толщиной v при разности температур ΔТ равен:
Тепловой поток, проходящий через стену площадью A и толщиной v при разности температур ΔТ равен:
Q. = k A ΔT.
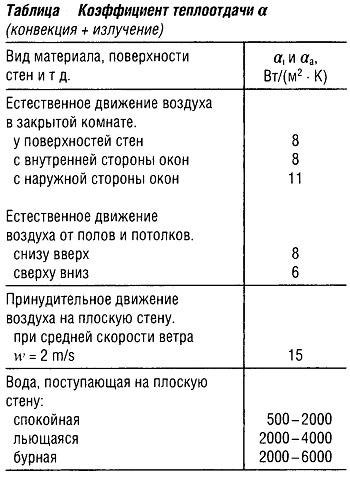
Коэффициент теплопередачи k вычисляется из формулы (a и аa см. табл. «Коэффициент теплоотдачи a» ):
1/k = 1/a1 + s/λ + 1/aa
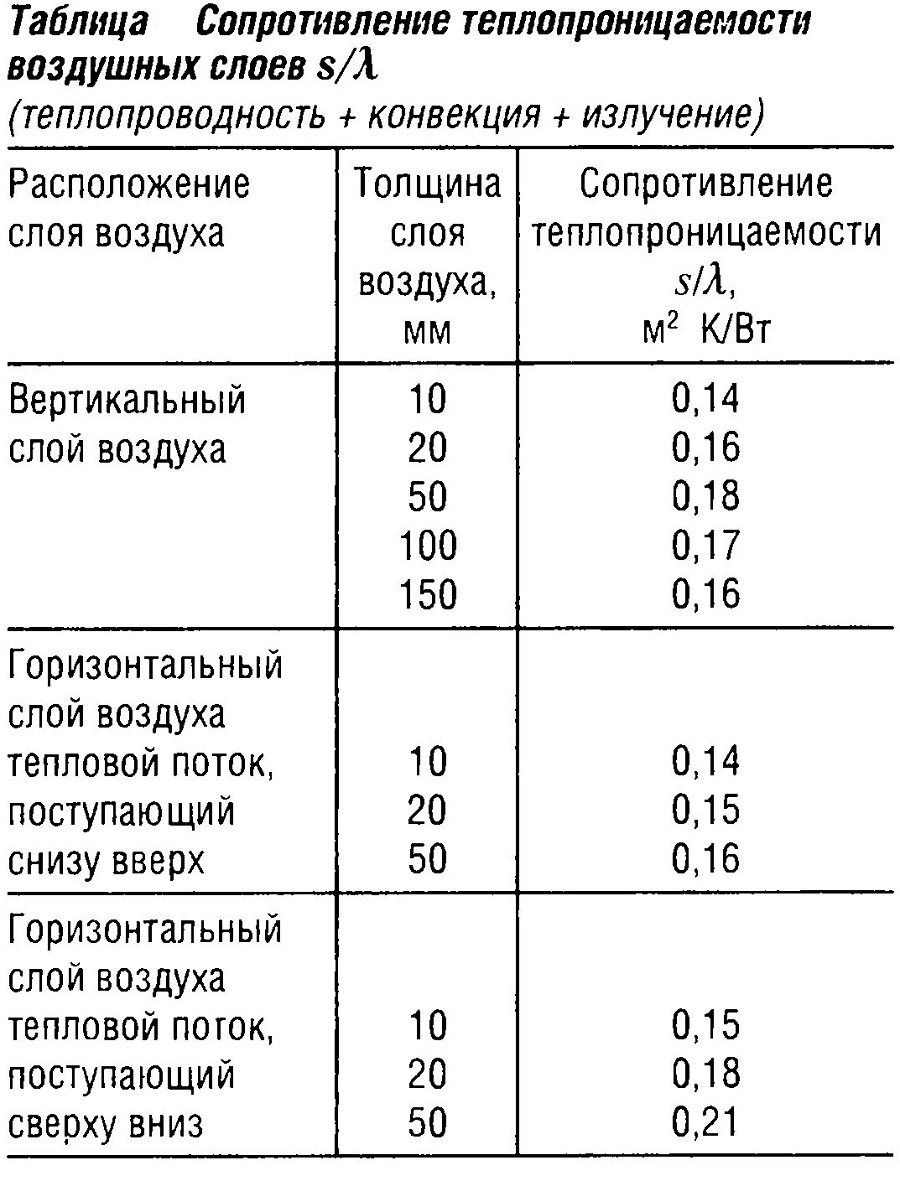
Сопротивление теплопроницаемости
Сопротивление теплопроницаемости суммируется из сопротивлений теплопроницаемости отдельных слоев стены (см. табл. «Сопротивление теплопроницаемости воздушных слоев s/λ» ):
s/λ = s1/λ1 + s2/λ2+ …..
Абсолютно черное тело
«Абсолютно черное тело» поглощает все падающее на него тепловое излучение, поэтому, когда оно нагревается, то излучает максимальное количество света, которое может выделить тело.
Законы термодинамики
Первый закон термодинамики
Энергия не возникает из ничего и не исчезает бесследно. Энергия может лишь преобразовываться в другие виды энергии, например, тепловая энергия — в механическую. В замкнутой системе энергия является постоянной. Система считается замкнутой, если не происходит перехода вещества в нее и за ее пределы, т.е. если масса системы остается постоянной. Исходя из этого, можно принять следующую формулировку: в замкнутой системе сумма всех изменений ее внутренней энергии равна нулю.
Второй закон термодинамики
Все естественные и искусственные процессы преобразования энергии необратимы, т.е. они не полностью обратимы. Так, теплота не может полностью превращаться в другой вид энергии, например, в механическую энергию, именно поэтому энергия, которая может быть преобразована в механическую энергию, всегда меньше теоретического оптимума. Следовательно, все процессы, связанные с трением, необратимы. Теплота, согласно второму закону термодинамики, в естественных условиях не может передаваться от тела с более низкой температурой к телу с более высокой температурой.
Энтропия
Энтропия — мера теплообмена между двумя телами. Она не является непосредственно измеряемой величиной, как давление или температура. Оценивать можно только изменение энтропии. Энтропия, по словам Людвига Больцмана (1877), может также интерпретироваться как вероятность распределения молекул двух газов. В замкнутой системе изменение энтропии идеального, обратимого процесса равно нулю. Обратимым называется процесс, который может без потерь возвращаться к своему первоначальному состоянию.
Противоположны такому процессу необратимые процессы, которые встречаются в технологии (например, процессы, связанные с трением, теплопроводимостью или смесеобразованием). Существующие в реальном мире необратимые процессы обнаруживают увеличение энтропии. Поэтому энтропия подходит для описания явлений, сопровождаемых потерями на трение. Еще одним примером процессов, связанных с трением, являются попытки Джеймса Прескопа Джоуля увеличить температуру в сосуде за счет использования мешалки, однако это необратимый процесс. Передача тепла возможна только от горячего предмета к холодному, а не наоборот. Феномен потерь (например, потерь течения, связанных с вязкостью) при дросселировании или при смешивании двух жидкостей, движущихся без расслоения и диффузии, объясняется энтропией.
Энергия
Наиболее важной формой энергии в термодинамике является тепловая энергия. Существуют также другие формы энергии, например, кинетическая, электрическая и химическая.
Эксергия
Эксергия — это энергия, равная максимально полезной работе, которая может быть совершена при переходе из данного состояния в состояние равновесия с окружающей средой. Фактическая доля эксергии понижается из-за потерь (на передачу тепла, трение, химические реакции, процессы перемешивания).
Анергия
Соответственно, анергия обозначает часть энергии, которая не может быть превращена в работу. Энергия, таким образом, состоит из эксергии и анергии.
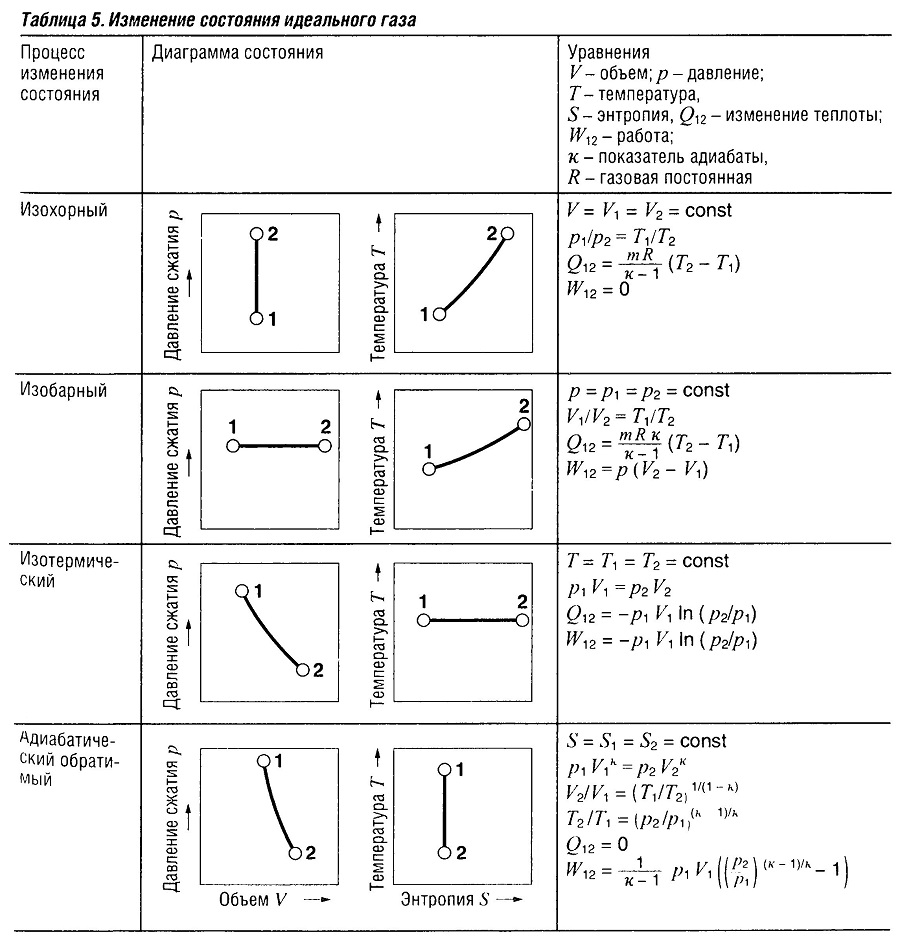
Изменения состояния идеального газа
Действительные изменения объема, давления или температуры газов заменяются упрощенной моделью изменений состояния идеального газа или аппроксимируются последовательностью изменений состояния идеального газа. Прикладной интерес представляют изохорный (при постоянном объеме), изобарный (при постоянном давлении), изотермический (при постоянной температуре) и адиабатический обратимый (без обмена теплоты) процессы. Адиабатический обратимый процесс часто используется при быстрых изменениях состояния.
В Таблице «Изменение состояния идеального газа» приведены данные для идеального газа и замкнутой системы, масса которой остается постоянной. Расчет выполненных работ производится с использованием интеграл ∫pdV. Подведение и убывание теплоты являются следствием первого закона термодинамики, энтропия — второго закона.
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ: