Электрохимия рассматривает системы и межфазные границы при протекании через них электрического тока. Она исследует процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия рассматривает процессы окисления и восстановления, протекающие на электродах, перенос ионов и электронов. Вот о том, какую роль играет электрохимия в автомобилестроении, мы и поговорим в этой статье.
Проводимость электролитов и электролиз
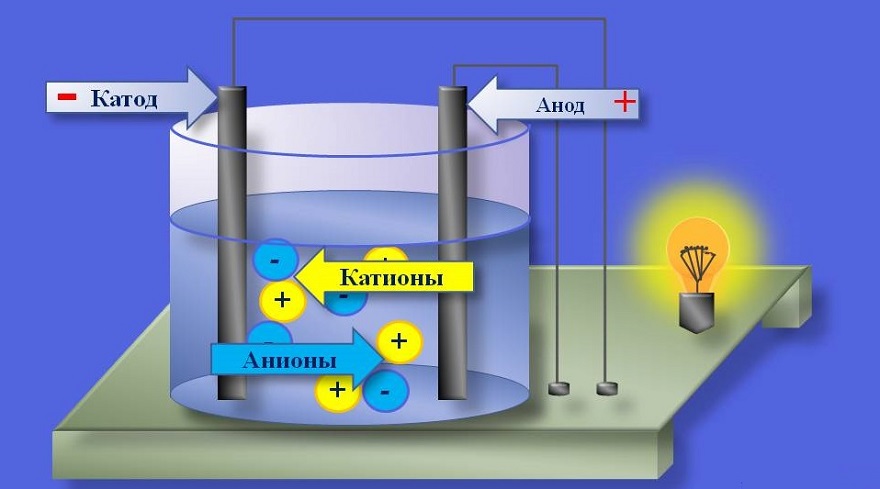
При растворении соли в воде ее компоненты присутствуют в воде в форме ионов. Эти ионы заряжены таким образом, что под воздействием электрического поля они перемещаются, соответственно, генерируя электрический ток. Данное явление известно, как электропроводность электролита. Для сравнения, ток в электрическом проводнике, например, меди или железе, представляет собой поток электронов. Помимо водных растворов, электролитами могут быть расплавы солей, а также некоторые твердые вещества (например, диоксид циркония в каталитических нейтрализаторах легковых автомобилей).
Отрицательно заряженные ионы перемещаются в сторону анода (положительный полюс) и поэтому называются анионами, в то время как положительно заряженные ионы (катионы) притягиваются катодом (отрицательный полюс). На данных электродах происходит химическая реакция, во время которой ионы либо поглощают электроны, расположенные на катоде, либо высвобождают электроны, которые оседают на аноде. Эти реакции могут происходить, только в том случае, если катод и анод имеют электропроводящее соединение друг с другом для обеспечения обмена электронами между ними.
Электрохимические ряды металлов
Интенсивность, с которой происходит данная реакция, определяется электрохимическим рядом металлов, приведенным в табл. «Электрохимический ряд металлов и соответствующие ионные реакции«.  В таблице указан нормальный потенциал Е°, соответствующий концентрации 1 моль/л. Данная «нормальная» концентрация показана надстрочным индексом 0. Напряжения, приведенные в таблице, относятся к стандартному нормальному водородному электроду, потенциал которого принимается равным 0 В. Соответственно, допустимо следующее:
В таблице указан нормальный потенциал Е°, соответствующий концентрации 1 моль/л. Данная «нормальная» концентрация показана надстрочным индексом 0. Напряжения, приведенные в таблице, относятся к стандартному нормальному водородному электроду, потенциал которого принимается равным 0 В. Соответственно, допустимо следующее:
Е°(2Н+ + 2е— <—> Н2) = 0 В.
В табл. 1 знак «плюс» для Е° показывает поглощение электронов (восстановление), а «минус» означает их высвобождение (окисление). Например, литий в основном высвобождает электроны (Е°<0) и окисляется, превращаясь в однозарядный ион Li+, в то время как фтор поглощает электроны (Е°>0) и таким образом восстанавливается.
Окисление: 2 Li —> 2 Li+ + 2e—,
ЕLi = +3,045 В.
Восстановление: F2 + 2е— —> 2 F—,
EF= +2,87 В.
Уравнение баланса:
2 Li+F2 —> 2 Li++2 F—,
Е= + 5,915 В
Электрохимическая реакция, таким образом, всегда состоит из двух неполных этапов окисления и восстановления. Поскольку литий высвобождает электроны, они стоят с правой стороны уравнения реакции в сравнении с обозначением в электрохимическом ряду металлов (табл. «Электрохимический ряд металлов и соответствующие ионные реакции» ). Таким образом, знак перед значением напряжения для данного уравнения окисления меняется на противоположный. Общее напряжение Е окислительно-восстановительной реакции складывается из отдельных напряжений. Соответственно, уравнение баланса не учитывает электроны, поскольку обмен ими происходит только между реагирующими веществами.
Электрохимическая реакция, таким образом, может происходить только в том случае, если общее напряжение является положительным. Поэтому кислоты (например, ионы Н+) не могут растворять медь, серебро, платину и золото. Эти металлы называются благородными. В противоположность им, неблагородные металлы, такие как натрий, элементарное железо, никель и свинец подвержены воздействию кислот и растворяются как ионы.
Чтобы электрохимическая реакция могла произойти, требуется как минимум два разных реагента. Результирующее общее электрохимическое напряжение Е зависит от концентрации ионов.
Уравнение Нернста
Уравнение Нернста выглядит так:
Е=Е°+(RT/nF·ln[OX]/[Red])=Е°+(0,0592В/n)·log10[OX]/[Red] (при 25 °С)
где:
[Ох] — концентрация окислившихся ионов,
[Red] — концентрация восстановленных ионов,
п — количество электронов в уравнении реакции,
R — газовая постоянная,
Т — абсолютная температура
F-постоянная Фарадея.
В этом случае потенциал может рассчитываться для каждой частичной химической реакции с отдельными типами ионов. Общее напряжение электролитической реакции суммируется из общего количества всех потенциалов частичных реакций. Кроме того, Е зависит от температуры.
Свинцовая аккумуляторная батарея
Заряд и разряд
В свинцовых аккумуляторных батареях легковых автомобилей происходят следующие электрохимические реакции разряда:
анод: РЬ —> РЬ2+ + 2е—;
катод: РЬ4+ + 2е— —> РЬ2+.
Эти реакции происходят в серной кислоте, где свинцовый сурик катода (РЬO2 с РЬ4+) восстанавливается до сульфата свинца (PbSO4 с РЬ2+), в то время как на аноде элементарный свинец (РЬ) аналогично окисляется до сульфата свинца. Электролит, таким образом, теряет ионы SO4 (сульфат) и его плотность уменьшается. В процессе заряда сульфат свинца превращается обратно в свинец и свинцовый сурик.
Серная кислота H2SO4 не включена в уравнения реакции, приведенного выше, в целях акцентирования внимания на центральных реакциях. Эти реакции обеспечивают напряжение на уровне примерно 2,0 В (см. табл. «Электрохимический ряд металлов и соответствующие ионные реакции» ). Данные реакции происходят в обратном направлении при заряде аккумуляторной батареи во время движения автомобиля.
Поскольку описанная выше электрохимическая реакция протекает очень медленно, электроды выполняются в виде решетки для обеспечения большой поверхности реакции. Свинец и свинцовый сурик изготавливаются в виде пористой губкообразной пасты и наносятся на эти решетки.
Аккумуляторная батарея должна перезаряжаться без падения напряжения при полном заряде в процессе работы. Она также должна быть рассчитана на хранение большого объема энергии при минимальной массе (емкости) и обеспечение высокой силы тока.
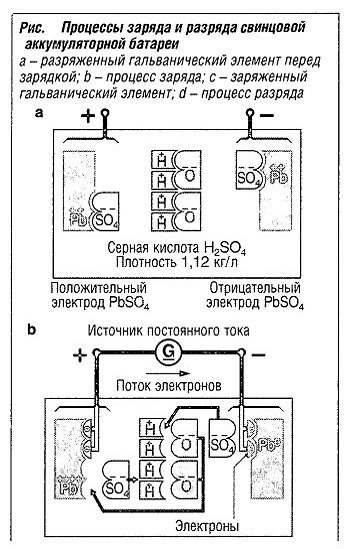
В частности, происходят процессы, показанные на рис. «Процессы заряда и разряда свинцовой аккумуляторной батареи«.
 |
 |
Разряженный гальванический элемент перед зарядом
На обоих электродах располагается сульфат свинца PbSO4, имеющий два иона — РЬ2+ и SO42- (рис. а, «Процессы заряда и разряда свинцовой аккумуляторной батареи» ). Электролит имеет меньшую плотность, поскольку он теряет ионы сульфата при потреблении тока.
Процесс заряда
На положительном электроде РЬ2+ превращается в РЬ4+ благодаря эмиссии электронов (рис. в, «Процессы заряда и разряда свинцовой аккумуляторной батареи» ). Он объединяется с кислородом и образует РЬO2. С другой стороны, на отрицательном электроде формируется элементарный свинец. Обе эти реакции сопровождаются высвобождением ионов сульфата SO42-, которые вместе с ионами Н+ снова образуют серную кислоту и, соответственно, увеличивают плотность электролита.
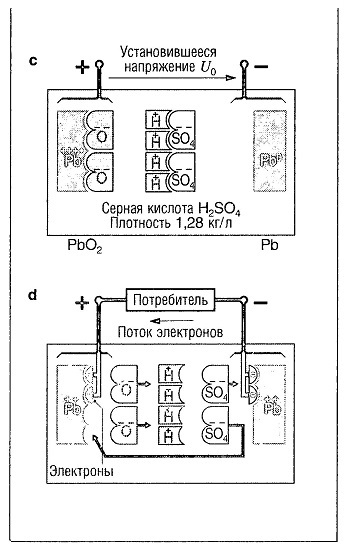
Заряженный гальванический элемент
PbS04 на положительном электроде превращается в PbO2, a PbSO4 на отрицательном электроде превращается в РЬ (рис. с, «Процессы заряда и разряда свинцовой аккумуляторной батареи» ). дальнейшего увеличения плотности электролита не происходит.
Если после достижения состояния полного заряда на гальванический элемент продолжает действовать напряжение заряда, происходит только электролитическое разложение воды. Оно сопровождается выделением гремучего газа (кислород на положительном электроде, водород на отрицательном).
Процесс разряда
Направление тока и электрохимические процессы при разряде являются противоположными по отношению к зарядке, что приводит к тому, что ионы РЬ2+ и SO42- на обоих электродах объединяются и образуют продукт разряда PbSO4 (рис. d, «Процессы заряда и разряда свинцовой аккумуляторной батареи» ).
Никель-металлогидридная аккумуляторная батарея
В гальваническом элементе NiMH (никель-металлогидрид) используется металлический электрод, способный аккумулировать водород. 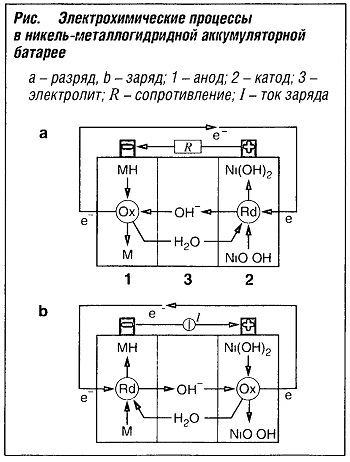 В процессе заряда аккумуляторной батареи генерируется атомарный водород. Этот водород поглощается металлическим электродом (М) с образованием металлогидрида (МН). При разрядке накопленный водород окисляется на электроде, превращаясь в воду (рис. «Электрохимические процессы в никель-металлогидридной аккумуляторной батарее» ). При заряде наблюдается обратный процесс:
В процессе заряда аккумуляторной батареи генерируется атомарный водород. Этот водород поглощается металлическим электродом (М) с образованием металлогидрида (МН). При разрядке накопленный водород окисляется на электроде, превращаясь в воду (рис. «Электрохимические процессы в никель-металлогидридной аккумуляторной батарее» ). При заряде наблюдается обратный процесс:
Анод: МН + ОН——> М + Н2O + е— (0,83 В).
Катод: NiOOH + H2O + e— —> Ni(OH)2 + ОН— (0,49 В)
Уравнение окислительно-восстановительной реакции:
MH + NiOOH —> Ni(OH)2 + M (1,32 В)
Никель-металлогидридные аккумуляторные батареи имеют высокую интенсивность саморазряда, до 1 % при комнатной температуре, что ограничивает их использование только оборудованием с коротким сроком службы. Они часто применяются в электромобилях и гибридных транспортных средствах, поскольку обеспечивают большую силу тока и высокую зарядную емкость при малом весе.
Литий-ионная аккумуляторная батареи
Литий-ионная аккумуляторная батарея использует принцип обратимого присоединения ионов лития (Li+) к решетке и удаления их (интеркалпрованный электрод). 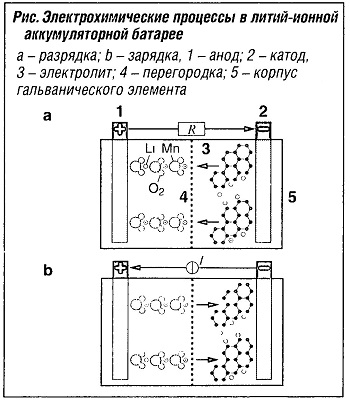 Например, графит (С) различных модификаций используется в качестве материала для анода, а оксиды металлического лития (например, LiСоO2, LiМn2O4) применяются как материал для катода (рис. «Электрохимические процессы в литий-ионной аккумуляторной батарее» ).
Например, графит (С) различных модификаций используется в качестве материала для анода, а оксиды металлического лития (например, LiСоO2, LiМn2O4) применяются как материал для катода (рис. «Электрохимические процессы в литий-ионной аккумуляторной батарее» ).
Анод: LixСn—> п С + x Li+ + хе—.
Катод: Li1-xMn2O4 + х Li+ +х е— —> Li Мn2O4 +nC
Уравнение баланса:
Li1-xМn2O4 + LixCn —> Li Mn2O4 + п О.
В зависимости от используемого катода (каменноугольный кокс), что выражается с помощью индекса п, соотношение х интернированного лития меняется. Электролит состоит из смешанного неводного растворителя (например, поливинилиденфторида) и проводящей соли (например, LiPF6).
Литий-ионные аккумуляторные батареи обладают высокой плотностью энергии, термостабильностью и обеспечивают напряжение до 4,2 В.
Коррозия и защита от коррозии
В случае коррозии в водной или газообразной среде происходят нежелательные электрохимические реакции, способные разрушить компоненты (например, кузов) или даже вызвать отказ компонентов. В такой ситуации, к примеру, атомы железа кузова разлагаются как ионы, в результате чего толщина листа металла уменьшается, могут появиться сквозные отверстия в металле и, помимо ухудшения внешнего вида (очаги коррозии), вся механическая жесткость автомобиля может быть снижена.
Задачей автомобильной промышленности является защита металлических компонентов автомобилей от коррозии различными способами. Для этих целей металл может покрываться основным веществом, таким как цинк, который, при необходимости, подвергается коррозии вместо стали. В качестве альтернативного способа за счет ингибиторов может вызываться реакция окисления, в то время как лакокрасочное покрытие замедляет диффузию кислорода с поверхностью металла.
Коррозионное разрушение
Как и электрохимическая реакция, коррозионное разрушение состоит из двух частичных реакций — анодного окисления и катодного восстановления. В случае окисления, атомы металла теряют электроны и растворяются в виде ионов или образуют отложения на поверхности («побежалость») с другими реагирующими веществами. Этот процесс составляет основу коррозионной реакции. В отличие от электрохимической реакции, коррозионное разрушение происходит само по себе, т.е. для него не требуется источник напряжения.
В процессе восстановления ионы кислорода и водорода часто выступают в роли реагирующих веществ для анодного растворения металла. В нейтральной или щелочной среде кислород восстанавливается до ионов гидроксида:
O2 + 2 Н2O+ 4 е— —> 4 ОН—.
В кислотной среде ионы водорода кислоты реагируют с образованием водорода, который выделяется в виде газа.
2 Н+ + 2 е— —> Н2
Элекрохимический ряд металлов (табл. «Электрохимический ряд металлов и соответствующие ионные реакции» ) показывает, насколько велик риск коррозии для различных металлов и какие материалы могут защитить от коррозии. В таблице не дается информация о скорости распространения коррозионной реакции. В таблице также не учитывается тот факт, что многие металлы (такие как алюминий, например) в воздушной среде образуют слой оксида, обеспечивающий временную защиту от коррозии.
Датчики концентрации кислорода
Датчик концентрации кислорода (λ-датчик) измеряет содержание остаточного кислорода в отработавших газах и таким образом 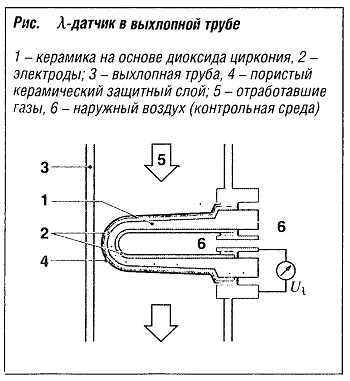 регулирует подачу воздуха для формирования оптимальной топливно-воздушной смеси для сгорания в двигателе с искровым зажиганием (λ = 1, стехиометрическое горение). В этой связи в качестве твердого электролита используется керамика на основе диоксида циркония (ZrO) (рис. «λ-датчик в выхлапной трубе» ), поскольку она проводит ионы кислорода при температурах выше 300 °С. В качестве электродов используются электроды из химически инертной платины, наносимой в виде толстого пористого слоя. Напряжение Uλ, создаваемое на электродах, можно рассчитать с помощью уравнения Нернста. Если [Ох] и [Red] заменить на парциальное давление кислорода p(O2) в контрольной среде (окружающий воздух) и среде отработавших газов, получается следующее соотношение:
регулирует подачу воздуха для формирования оптимальной топливно-воздушной смеси для сгорания в двигателе с искровым зажиганием (λ = 1, стехиометрическое горение). В этой связи в качестве твердого электролита используется керамика на основе диоксида циркония (ZrO) (рис. «λ-датчик в выхлапной трубе» ), поскольку она проводит ионы кислорода при температурах выше 300 °С. В качестве электродов используются электроды из химически инертной платины, наносимой в виде толстого пористого слоя. Напряжение Uλ, создаваемое на электродах, можно рассчитать с помощью уравнения Нернста. Если [Ох] и [Red] заменить на парциальное давление кислорода p(O2) в контрольной среде (окружающий воздух) и среде отработавших газов, получается следующее соотношение:
Uλ = (RT/4F)·ln(pr(O2)/pA(O2))
Здесь pА(O2) означает парциальное давление кислорода в отработавших газах, pR(O2) — парциальное давление кислорода в контрольной среде, R — газовая постоянная, Т— абсолютная температура и F- постоянная Фарадея.
В районе λ = 1 колебания напряжения очень велики, что позволяет с успехом регулировать данное значение.
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ: